Latihan Dan Kuis 3
(Kimia B)
Untuk cara cepatnya, kamu bisa pake cara penyetaraan reaksi kimia, cari dulu mol produk, kemudian masukkan sebagai koefisien reaksi. Selanjutnya, setarakan reaktannya.
n CO2 = gr/Mr = 88/44 = 2
n H2O = gr/Mr = 54/18 = 3
Reaksi awal
CxHyOz+O2 → Co2+H2O
Reaksi Setara
C2H6O + 3O2 → 2CO2 + 3H2O
Jadi, rumus empirisnya CxHyOz adalah C2H6O
Jawaban : 0,1 M/detik dan 0,2 M/detik
Persamaan reaksi : 2 HI(g) → H2(g) + I2(g)
Mula-mula : 4 mol – –
Setelah 5 detik : 2 mol 1 mol 1 mol

Persamaan reaksi netralisasi CH3COOH dengan NaOH:
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Dari persamaan reaksi, diperoleh: 1 mol CH3COOH
4. Sebanyak 6 liter gas Argon bersuhu 27°C pada tekanan 1 atm( 1 atm = 10^5 Pa) berada di dalam tabung. Jika konstanta gas umum R = 8,314 J mol−1 K−1 dan banyaknya partikel dalam 1 mol gas 6,02 x 10^23 partikel, maka banyak partikel gas Argon dalam tabung tersebut adalah…..
Jawaban : 0,12 x 10²³ partikel
Pembahasan:
Diketahui : V = 6 L T
= 27 C P = 10^5 Pa
R = 8,314 J/mol K
Ditanya : N = ?
Jawab :
a. PV = nRT
10^5
x 6 L = n x 8,314 J/mol K x 300 K
n = 0,02 mol
b. N = n x Na
N =
0,02 mol x 6,02 x 10²³ partikel
N = 0,12 x 10²³ partikel
CO(g) + 3H2(g) → CH4(g) + H2O(g)
Pada P dan T yang sama, volume gas CH4 (Mr = 16) yang dihasilkan dari 0,7 g gas CO (Mr = 28) adalah seperempat dari volume 2,8 g gas X. Massa molekul relatif gas X adalah ....
0,7 g CO = 0,7 g : 28 g/mol
0,7 g CO = 0,025 mol
Berdasar persamaan reaksi setara CO(g) + 3H2(g) → CH4(g) + H2O(g)
maka jumlah gas CH4 sama dengan jumlah gas CO karena koefisien kedua gas tersebut sama.
Jumlah gas CH4 = 0,025 mol (n2)
Persamaan untuk gas X
→ P1V1 = n1RT1
→ R = P1V1/n1T1
Persamaan untuk gas CO2
→ P2V2 = n2RT2
→ R = P2V2/n2T2
Karena P1 = P2 dan T1 = T2
→ P1V1/n1T1 = P2V2/n2T2
→ V1/n1 = V2/n2
V2 = ¼ V1
atau
V1 = 4V2
Proses hitung:
V1/n1 = V2/n2
4V2/n1 = V2/0,025 mol
4/n1 = 1/0,025 mol
n1 = 4 × 0,025 mol
n1 = 0,1 mol
Jumlah gas X = 0,1 mol
Massa molar X = massa X : jumlah gas X
Massa molar X = 2,8 g : 0,1 mol
Massa molar X = 28 g/mol
Mr X = 28
Kuis 3 [Kembali]
1. 1 liter gas hidrogen bereaksi dengan 1 liter gas klorin, sehingga dihasilkan 2 liter gas hidrogen klorida. Jika gas hidrogen yang direaksikan 5 liter, tentukan gas hidrogen klorida yang dihasilkan!
Jawaban : 10 liter.
Pembahasan:
Untuk menentukan volume gas hidrogen klorida yang dihasilkan, bisa menggunakan perbandingan berikut dengan anggapan suhu dan tekanan tidak berubah.
Volume H2 : Volume Cl2 : Volume HCl
1 1 2
5 5 10
Jadi, volume gas hidrogen klorida yang dihasilkan adalah 10 liter.
2. Faktor-faktor yang mempengarhi besarnya tekanan adalah …
Jawaban : Luas bidang tekan dan gaya tekan
Semakin luas bidang tekan semakin kecil tekanan
Semakin besar gaya tekan semakin besar tekanan.
Pembahasan :
(a) H20 = elektrolit lemah
(b) KCL = garam/non elektrolit
(c)HNO3 = elektrolit kuat
(d)CH3COOH =elektrolit lemah
(e)C12H12011 = non elektrolit
CHAPTER 5
 yang mengandung 6n buah molekul
yang mengandung 6n buah molekul 
CHAPTER 6
1. Suatu campuran pereaksi di dalam tabung reaksi meyebabkan tabung tersebut menjadi panas jika dipegang. Penyataan yang tepat mengenai hal tersebut adalah….
Jawaban :
Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
Pembahasan:
Jika suatu reaksi kimia menghasilkan panas, maka reaksi tersebut merupakan reaksi eksoterm. Pada reaksi eksoterm, entalpi reaksi bernilai negative (entalpi pereaksi lebih besar daripada entalpi hasil reaksi)
2. Dalam suatu calorimeter direaksikan 200 cm³ larutan NaOH 1 M dengan 200 cm³ larutan HCl 1 M, ternyata suhunya naik dari 29°C menjadi 36°C Kalor jensi larutan dianggap sama dengan kalor jenis air, yaitu 4,18 J/g°K dan massa jenis larutan dianggap 1 g/cm³.
Jika dianggap bahwa calorimeter tidak menyerap kalor, tentukanlah perubahan entalpi dari reaksi:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l)
Jawaban :
-11,704 kJ
Pembahasan:
qreaksi = -(qkalorimeter + qlarutan)
Oleh karena calorimeter tidak menyerap kalor, maka:
qreaksi = – qlarutan
volume = v NaOH + v HCl
= (200 + 200) mL
= 400 mL
massa larutan = volume larutan x rapatan larutan
= 400 mL x 1 gram/mL
= 400 gram
ΔT = (36 – 29 )°C
= 7°C
Atau ΔT = (36+273) – (29+273)
= 7 K
qlarutan = mlarutan x clarutan x ΔT
= 400 gram x 4,18 J/g K x 7 K
= 11.704 joule = 11,704 kJ
NaOH = HCl = 0,1L x 1 mol/L = 0,1 mol
Jadi pada reaksi antara 0,1 mol NaOH dengan 0,1 mol HCl terjadi perubahan kalor sebesar : qreaksi = – qlarutan
qreaksi = – 11,704 kJ
Maka, untuk setiap 1 mol NaOH yang bereaksi dengan 1 mol HCl akan terjadi perubahan kalor sebesar:
qreaksi = – 11,704 kJ/0,1 mol = – 11,704 kJ/mol
Perubahan kalor yang bertanda negative menunjukkan reaksi berlangsung secara eksoterm. Pada tekanan konstan, perubahan kalornya sama dengan perubahan entalpinya. Persamaan termokimianya:
NaOH (aq) + HCl (aq) → NaCl (aq) + H2O (l) ΔH= -11,704 kJ
CHAPTER 7
1. Bilangan kuantum azimuth (l) yang masih dimungkinkan untuk l = 4 adalah . . . .
Harga l = 0, .....(n-1) = 0, 1, 2, 3
2. Unsur ini memiliki diagram orbital sebagai berikut.
Nomor atom Ar = 18
Nomor atom X = Ar + 3 = 18 + 3 = 21
CHAPTER 8
1. Bila kedua unsur tersebut berikatan, maka rumus senyawa yang dihasilkan adalah…
Jawaban : X2Y3
Pembahasan :
menentukan rumus senyawa.
Untuk mengetahui rumus senyawa yang dihasilkan, kita perlu melihat berapa elektron yang dilepas atau diterima oleh masing-masing unsur.
Untuk itu, akan sangat membantu jika kita mengetahui konfigurasi elektron ataupun letak mereka di sistem periodik secara sederhana seperti berikut :
13X : 2 8 3 → golongan IIIA melepas 3 elektron
17Y : 2 8 7 → golongan VIIA menerima 1 elektron
Jadi, rumus senyawa yang terbentuk adalah XY3.
2. Manakah sifat gas mulia yang makin berkurang dengan bertambahnya nomor atom. . .
Jawaban : Energi ionisasi
Pembahasan:
Sifat umum gas mulia:
- Jari-jari atomnya semakin besar, akibatnya dari He ke Rn semakin mudah membentuk dipol sesaat dan gaya van der waals semakin kuat.
- Semakin kuatnya gaya van der waals (dari He ke Rn) menyebabkan titik didih dan titik leleh gas mulia dari atas ke bawah semakin tinggi.
- Energi ionisasinya semakin kecil, bahkanuntuk Xe dan Rn mempunyai energi ionisasi yang lebih rendah dari hidrogen (energi ionisasi hidrogen: 1.312 kJ/mol)
CHAPTER 9
1. Diketahui beberapa unsur dengan konfigurasi electron sebagai berikut:
- P: 2 8 7
- Q: 2 8 8 1
- R: 2 8 18 2
- S: 2 8 8
- T: 2 8 18 4
Diantara unsur di atas, yang paling stabil (paling sukar membentuk ikatan kimia) adalah …
Jawaban : S
Pembahasan:
Unsur yang paling stabil atau yang paling sukar berekasi yaitu adalah unsur golongan gas mulia. Gas mulia mempunyai kofigurasi penuh, yaitu konfigurasi octet yaitu yang memiliki 8 elektron pada kulit terluarnya.
Pada soal, jumlah masing masing konfigurasi electron sangat beragam, tetapi yang sangat stabil dan paling sukar membentuk ikatan kimia yaitu S dengan jumlah electron 18, yang electron terluarnya 8, dan sangat stabil dan tidak bisa berikatan lagi dengan unsur lain.
2. Perhatikan gambar berikut.
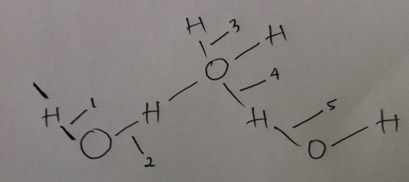
Ikatan hidrogen ditunjukkan oleh ….
Jawaban : 4
Pembahasan:
Ikatan hidrogen ditunjukkan oleh nomor 4. Karena atom H lebih bermuatan postif dan atom O lebih bermuatan negatif, sehingga antar atom O pada molekul satu dengan atom H pada molekul berikutnya terjadi ikatan hidrogen.
Sedangkan pada nomor 1, 2, 3, dan 5 bukan kiatan hidrogen itu merupakan ikatan kovalen karena antara atom H dan O mereka saling berikatan dalam satu molekul, atau terjadinya pemakaian pasangan elektron bersama.
Jawaban : Segitiga Planal
Pembahasan :
Paling polar --> beda kelektronegatifan besar
HF --> golongan IA dan VIIA maka elektronegatifitasnya besar












